Автор публикации:
Трушенко Наталья Владимировна – к.м.н., ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), кафедра пульмонологии, доцент, ФГБУ «НИИ пульмонологии» ФМБА России, медицинский центр, врач-пульмонолог.
Проблемные аспекты в использовании дозированных порошковых ингаляторов у пациентов с хронической обструктивной болезнью легких

Основой лечения хронической обструктивной болезни легких (ХОБЛ) является ингаляционная терапия, включающая бронходилататоры различных классов и глюкокортикостероиды в различных комбинациях.
Ингаляционная терапия ХОБЛ осуществляется с использованием следующих устройств доставки – дозированные аэрозольные ингаляторы (ДАИ), в том числе с улучшенной формой доставки экстрамелкодисперсных частиц, жидкостный аэрозольный ингалятор (Респимат®), дозированные порошковые ингаляторы (ДПИ) и небулайзеры. При этом выбор ингаляционного устройства существенно влияет на приверженность пациента и эффективность терапии16.
Ошибки в технике ингаляций встречаются более чем у половины пациентов с ХОБЛ30 и широко распространены при использовании разных средств доставки. При этом неправильная техника ингаляций почти в два раза увеличивает риск обострений, госпитализаций и связана с увеличением использования пероральных глюкокортикостероидов и системных антибиотиков10,11.

Общие принципы функционирования ДПИ

ДПИ используют лекарственное вещество в сухом виде (порошок), которое с помощью энергии вдоха пациента достигает его дыхательных путей. Функционирование всех известных ДПИ зависит от инспираторного усилия пациента, необходимого для того, чтобы «поднять» дозу препарата из резервуара (капсулы, блистера). Кроме того, в большинстве ДПИ частицы лекарственного препарата находятся в соединении с носителем – моногидратом лактозы, и инспираторный поток нужен для дезагрегации порошка и отделения лекарственных частиц от носителя (Рис. 1)39.
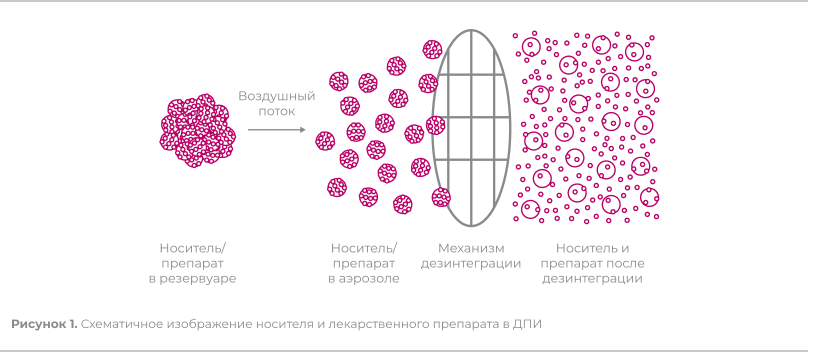
Таким образом, при использовании ДПИ пациент должен произвести резкий и при этом максимально глубокий вдох для активации устройства, однако около 32,1–38,4% пациентов не делают это24. Чем выше инспираторный поток пациента, тем большая доза достигает легких и меньшая оседает в ротоглотке. При этом следует отметить, что высокая орофарингеальная депозиция (50–80%) является довольно значимой проблемой при использовании ДПИ39.
Разные типы ДПИ отличаются по величине внутреннего сопротивления, зависящей от конструкции самого устройства14. При этом ДПИ с низким внутренним сопротивлением требуют более высокого инспираторного потока и характеризуются высокой вариабельностью дозы лекарственного препарата, достигающего нижних дыхательных путей.

Что такое пиковый инспираторный поток и методы его измерения

Пиковый инспираторный поток (ПИП) – максимальный воздушный поток, генерируемый пациентом во время вдоха, измеряется в литрах в минуту. Для каждого ДПИ существует минимальный ПИП, необходимый для активации устройства, и оптимальный ПИП, обеспечивающий доставку большей части препарата в нижние дыхательные пути и наилучший клинический эффект13, 19.
Для большинства ДПИ значение ПИП не менее 60 л/мин считается оптимальным для адекватной легочной депозиции препарата, в то время как ПИП менее 30 л/мин не позволяет лекарственному препарату достичь нижних отделов респираторного тракта2,4,22,30. При этом клиническая эффективность ДПИ при значении ПИП от 30 до 60 л/мин может быть недостаточна, поэтому при значении ПИП менее 60 л/мин предпочтительнее использовать аэрозольные ингаляторы6,11,24 (Табл. 1).

Критерии оптимальных значений ПИП зависят от типа ДПИ. Так, обычно для ДПИ с низким и средним сопротивлением оптимальным считается 60 л/мин, для приборов с высоким сопротивлением – 30 л/мин2,4. Например, при использовании ингалятора со средне-высоким сопротивлением Турбухалер® у пациентов с ПИП 60 л/мин высвобожденная доза будесонида составила 64%, а у пациентов с ПИП 30 л/мин – 38%35. При использовании другого ингалятора с высоким сопротивлением – Хандихалер® при ПИП 20 л/мин нижних дыхательных путей достигает 16,3%, а при ПИП 40 л/мин – 23,4% препарата9.
Непосредственное измерение ПИП наиболее часто проводится с помощью портативных инспираторных флоуметров. Наиболее широко используется In-Check DIAL® (Clement Clerke International Ltd., Harlow, Великобритания). Данный прибор имеет шкалу измерения скорости вдоха, односторонний мундштук с клапаном и регулируемый циферблат, который позволяет имитировать внутреннее сопротивление ДПИ33. In-Check DIAL® измеряет ПИП от 15 до 120 л/мин26. Производитель заявляет, что его точность составляет ±10%, или 10 л/мин33. В 2016 году была обновлена шкала In-Check DIAL (G16)®, которая на текущий момент позволяет оценивать ПИП на пяти разных уровнях сопротивления, соответствующих определенному типу ингаляторов (Рис. 2)1.

Перед использованием In-Check DIAL® врач устанавливает внутреннее сопротивление флоуметра, соответствующее сопротивлению ДПИ, которым пользуется пациент. У пациентов, использующих другие системы ингаляторов или не использующих ингаляторы, сопротивление In-Check DIAL® устанавливается в значениях, соответствующих низко- (R2) и высокорезистентным (R5) ДПИ. Исследуемому предлагают максимально выдохнуть, после чего сильно и быстро вдохнуть из инспираторного флоуметра, имитируя использование ДПИ. Рекомендуется проводить измерение ПИП три раза и выбирать максимальное значение.

Распространенность и факторы риска низкого ПИП

Недостаточный ПИП для пациентов с ХОБЛ является актуальной проблемой. По данным различных авторов, у 19–78% пациентов с ХОБЛ определяется субоптимальный ПИП26,22.
Ключевое значение для реальной клинической практики имеет выявление факторов риска низкого ПИП у пациентов с ХОБЛ, особенно учитывая отсутствие зарегистрированного в нашей стране портативного флоуметра для измерения ПИП.
Рассмотрим основные факторы риска низкого ПИП у пациентов с ХОБЛ, известные на сегодняшний день.
1. Возраст.
Во многих исследованиях подтверждается обратная связь между возрастом и уровнем ПИП, то есть увеличение возраста ассоциируется с уменьшением ПИП22,26,34.
2. Пол.
Многие исследования подтверждают, что у лиц женского пола ниже уровень ПИП26,27,34. Возможным объяснением служит то, что у женщин показатели функции легких, включая давление во рту при вдохе, ниже, чем у мужчин18.
3. Рост и вес.
Некоторые работы выявили прямую связь между показателем роста и ПИП, то есть чем ниже рост, тем ниже ПИП22,26. Отдельные исследователи выявили также связь между индексом массы тела и ПИП12,27, хотя в других работах такая взаимосвязь не подтвердилась22,26.
4. Сопутствующие заболевания.
Ряд исследований свидетельствует о влиянии ряда коморбидных заболеваний (бронхиальная астма, анемия, пневмония, ишемическая болезнь сердца) на показатель ПИП у пациентов с ХОБЛ15,21.
5. Функциональные показатели.
Наиболее часто в опубликованных работах приводились данные о взаимосвязи ПИП и объемом форсированного выдоха за 1 с, согласно которым у пациентов с более тяжелой степенью бронхиальной обструкции были достоверно ниже показатели ПИП15,27,32,34.
Многие исследования выявили связь между гиперинфляцией легких, формированием «воздушных ловушек» и ПИП. Так, показано, что по мере снижения емкости вдоха (Евд) снижается и ПИП17,36, и увеличение остаточного объема легких по отношению к общей емкости легких также ассоциируется со снижением ПИП17.

Клиническое значение ПИП

Результаты многих исследований свидетельствуют о взаимосвязи ПИП с тяжестью заболевания и интенсивностью симптомов при ХОБЛ2,3,6,21,23.
У пациентов с легкой, среднетяжелой и тяжелой степенью тяжести ХОБЛ значения ПИП были достоверно выше, чем у пациентов с очень тяжелой ХОБЛ20. У пациентов с субоптимальным ПИП среднее число обострений за год было достоверно выше, чем у пациентов с оптимальным ПИП31. Отдельные авторы подтвердили взаимосвязь между клиническими симптомами ХОБЛ, оцениваемыми по шкале CAT (COPD Assessment Test™), и уровнем ПИП21,25.
Кроме того, показано, что у пациентов с ХОБЛ с субоптимальным ПИП, получавших терапию через ДПИ, была выше частота обострений и госпитализаций25.
Эксперты рекомендуют измерять ПИП как у амбулаторных пациентов, так и у пациентов, находящихся в стационаре, для того, чтобы оценить необходимость смены ДПИ на другие ингаляционные устройства и повысить эффективность ингаляционной терапии25.
При этом важно отметить, что обучение пациентов правильной технике ингаляций способствует увеличению ПИП2,5–7,29. Положительное влияние на уровень ПИП оказывают и методы физической реабилитации, тренировки инспираторных дыхательных мышц37.
Выбор оптимального ингалятора требует оценки многих факторов – когнитивных функций пациента, тяжести заболевания, частоты обострений, коморбидных заболеваний, ловкости рук, силы кистей, ряда социально-экономических факторов38. При этом в случае использования ДПИ одним из условий эффективности проводимой терапии являются оптимальные значения ПИП пациента. В этой связи крайне важно помнить о факторах риска субоптимальных значений ПИП при ХОБЛ. В группе риска по недостаточному для эффективного использования ДПИ значению ПИП находятся пациенты с тяжелым течением и/или обострением ХОБЛ, эмфизематозным типом, легочной гиперинфляцией, пациенты старшего возраста, женского пола с низким ростом и ожирением, а также с отягощенным коморбидным фоном.
Foster/ website 25/12/2023 RUS_42