Автор публикации:
Черняк Александр Владимирович – к.м.н., заведующий лабораторией функциональных и ультразвуковых методов исследования, Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства России, врач функциональной диагностики отделения функциональной и ультразвуковой диагностики, Государственное бюджетное учреждение здравоохранения города Москвы «Городская клиническая больница имени Д.Д. Плетнёва Департамента здравоохранения города Москвы».
Рассмотрены вопросы патофизиологии хронической обструктивной болезни легких (ХОБЛ), современные возможности функциональных методов исследования системы дыхания при ХОБЛ, описаны характерные изменения показателей легочных функциональных тестов при ХОБЛ.

Хроническая обструктивная болезнь легких (ХОБЛ) является распространенным заболеванием во всем мире и представляет глобальную медико-социальную и экономическую проблему во всех промышленно развитых странах1. Основным патофизиологическим критерием ХОБЛ является ограничение воздушного потока – обструкция дыхательных путей (ДП)1. При ХОБЛ обструкция дыхательных путей вызвана сочетанием заболевания периферических (или мелких) дыхательных путей (МДП) (это приводит к увеличению сопротивления ДП) и эмфиземы легких (которая приводит к деструкции эластических структур)1. Степень преобладания того или другого компонента патологических изменений органов системы дыхания при ХОБЛ различается у разных больных. Кроме того, эти изменения не всегда происходят одновременно и могут развиваться с разной скоростью во времени1.
Хроническое воспаление при ХОБЛ вызывает структурные изменения легочной ткани, а также сужение МДП, т. е. ДП с диаметром менее 2 мм. За счет деструкции эластических волокон межальвеолярных перегородок происходит снижение эластической тяги легких. Эти нарушения не позволяют ДП оставаться раскрытыми во время выдоха1. У пациентов с ХОБЛ было выявлено уменьшение количества МДП, что также может способствовать обструкции ДП и мукоцилиарной дисфункции2. Одной из причин уменьшения количества МДП может быть дисанапсис - несоответствие между объемом дыхательных путей относительно объема легких1. В совокупности все эти изменения ограничивают воздушный поток, снижают объем форсированного выдоха за первую секунду (ОФВ1) и отношение ОФВ1 к форсированной жизненной емкости легких (ФЖЕЛ), способствуют возникновению воздушной ловушки и гиперинфляции легких.
Согласно международным рекомендациям (Глобальная инициатива по хронической обструктивной болезни легких, GOLD – Global Initiative for Chronic Obstructive Lung Disease) при соответствующей клинической картине для подтверждения диагноза ХОБЛ обязательно необходимо установить наличие неполностью обратимого ограничения воздушного потока (измеренное с помощью спирометрии отношение ОФВ1/ФЖЕЛ после максимальной бронходилатации должно быть менее 0,7)1. В современных рекомендациях подчеркивается, что у некоторых людей могут наблюдаться структурные изменения легочной ткани (например, эмфизема) и/или функциональные нарушения (такие как наличие воздушной ловушки, легочной гиперинфляции, снижение диффузионной способности легких и/или быстрое снижение ОФВ1) без обструкции ДП (ОФВ1/ФЖЕЛ ≥ 0,7 после максимальной бронходилатации). Для таких пациентов предложили использовать термин «пред-ХОБЛ». У таких пациентов, а также людей с низкими показателями спирометрии и сохранным отношением ОФВ1/ФЖЕЛ (PRISm: preserved ratio impaired spirometry - после максимальной бронходилатации ОФВ1/ФЖЕЛ ≥ 0,7 и ОФВ1 < 80 % от референсного (должного) значения (%долж.)) возможно в дальнейшем развитие обструкции1. Для уточнения тактики ведения этих пациентов необходимы уточняющие исследования.
Таким образом, для установления диагноза ХОБЛ необходимо применение бронходилататоров и повторное проведение спирометрии, соответствующее критериям качества3. Величина показателя ОФВ1/ФЖЕЛ после применения бронхорасширяющих препаратов менее 0,7 подтверждает наличие ограничения скорости воздушного потока и, следовательно, ХОБЛ (при соответствующей клинической картине)1.
Использование фиксированного значения ОФВ1/ФЖЕЛ = 0,7 в качестве нижней границы нормы (НГН) для определения обструкции ДП может приводить к гипердиагностике ХОБЛ у лиц пожилого возраста, особенно при болезни легкого течения [4–6]. Hardie J.A. с соавт. обследовали пожилых людей (старше 70 лет), которые никогда не курили и не имели респираторных симптомов, и выявили у 35% этих людей снижение ОФВ1/ФЖЕЛ <0,70. Этот процент увеличивался с возрастом, и у лиц старше 80 лет составлял около 50%4.
Применение индивидуального расчетного значения НГН отношения ОФВ1/ФЖЕЛ позволяет существенно снизить процент ошибок при диагностике ХОБЛ. Программное обеспечение современных спирометров позволяет выводить на экран и/или протокол исследования для каждого пациента НГН и/или z-оценку, НГН соответствует z-оценке=-1,645. Так, из 2728 лиц старше 45 лет обструкция ДП была выявлена в 10,9% случаев (14,7% среди мужчин и 7,2% среди женщин) при использовании расчетной НГН и в 15,5% случаев (21,8% среди мужчин и 9,1% среди женщин) при использовании фиксированного значения 0,7 в качестве НГН ОФВ1/ФЖЕЛ. У лиц старше 65 лет обструкция ДП была выявлена в 14,9% случаев при использовании НГН и в 31,1% - при использовании фиксированного значения 0,75.
В работе Aggarwal A.N. с соавт.6 также было показано, что использование фиксированного значения ОФВ1/ФЖЕЛ<0,7 в качестве функционального показателя обструкции ДП обуславливает гипердиагностику у лиц среднего и пожилого возраста и недооценивает наличие обструктивных нарушений вентиляции у молодых. Таким образом, авторы пришли к выводу, что для оценки отклонения от нормы отношения ОФВ1/ФЖЕЛ целесообразно использовать НГН (или z-оценку), рассчитанную по соответствующему референсному уравнению.
Риск ошибочной диагностики ХОБЛ и назначения необоснованного лечения конкретных пациентов при использовании критерия ОФВ1/ФЖЕЛ <0,70 тем не менее не такой высокий, поскольку в клинической практике диагноз устанавливают с учетом соответствующей клинической картины заболевания и анализом факторов риска1.
При оценке ХОБЛ необходимо также оценить выраженность ухудшения бронхиальной проходимости. Для классификации степени тяжести обструкции ДП при ХОБЛ используют степень отклонения ОФВ1 после применения бронхорасширяющих препаратов от должного значения (табл. 1).

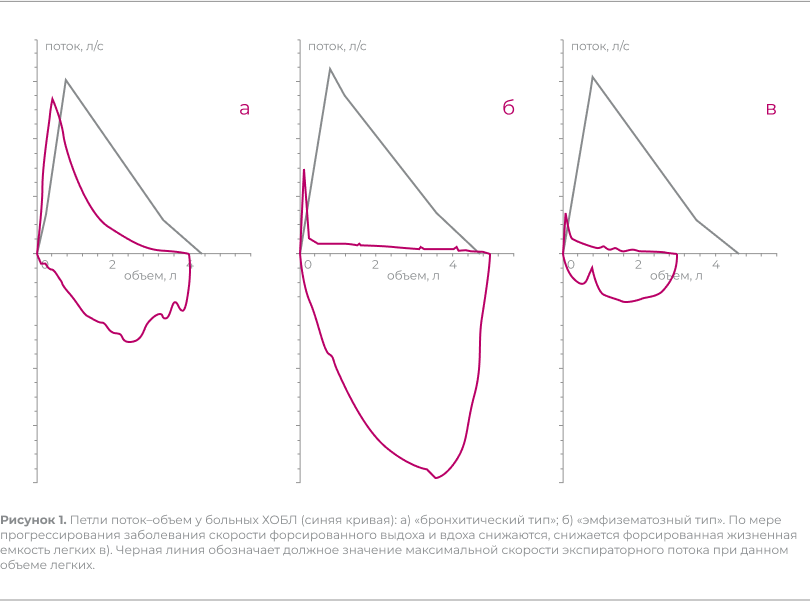
При интерпретации результатов спирометрии важно проводить не только количественный анализ ее показателей, но и качественный анализ кривых поток–объем форсированного выдоха. Вогнутая форма и пологая нисходящая часть экспираторной петли поток–объем свидетельствуют об обструктивных процессах (рис. 1а). При выраженной обструкции и эмфиземе легких кривая приобретает характерный изгиб: резкое снижение скорости экспираторного потока, следующее за пиком, сменяется пологим участком кривой, отражающим экспираторный коллапс дистальных отделов ДП (рис. 1б). По мере прогрессирования заболевания нарастает обструкция ДП, снижается ФЖЕЛ (рис. 1в).
Общеизвестно, что ХОБЛ – это заболевание, которое характеризуется частично обратимой обструкцией ДП1. Тем не менее, значительная часть пациентов с ХОБЛ может демонстрировать выраженный положительный бронходилатационный ответ7. Поэтому положительная реакция при бронходилатационном тесте не может служить методом дифференциальной диагностики между ХОБЛ и бронхиальной астмой.
Таким образом, форсированная спирометрия играет важную роль в диагностике ХОБЛ, оценке степени тяжести обструктивных нарушений и при длительном наблюдении пациентов с ХОБЛ. Однако, нужно принимать во внимание, что существует слабая корреляция ОФВ1 с симптомами заболевания и качеством жизни больных ХОБЛ.
Как было сказано выше, ключевым местом обструкции у пациентов с ХОБЛ являются МДП, а именно воспаление, отек и снижение проходимости1. Были выявлены корреляционные связи дисфункции МДП (ДМДП) с восприятием одышки и качеством жизни у пациентов с ХОБЛ8. ДМДП приводит к сужению их просвета вплоть до полного закрытия, следствием чего является задержка воздуха в альвеолах («воздушная ловушка») и неравномерное распределение вентиляции. Поэтому тесты, которые позволяют оценить эти изменения, могут быть полезными в клинической практике для выявления и количественной оценки ДМДП.
Одним из методов функциональной диагностики, который, в отличие от спирометрии, позволяет диагностировать ДМДП, является метод форсированных осцилляций, или его модификация – импульсная осциллометрия (ИОС). ИОС – это неинвазивный метод изучения механических свойств легких, основанный на анализе отраженных дыхательным аппаратом человека навязанных извне колебаний (осцилляций) в виде импульсов, подающихся специальным устройством — звуковым генератором. Каждый импульс содержит полный спектр анализируемых частот в диапазоне, существенно превышающем частоту спонтанного дыхания человека — от 5 до 35 Гц. ИОС позволяет измерять общее дыхательное сопротивление или дыхательный импеданс (Zrs) и его составляющие: фрикционное сопротивление (Rrs) и сумму эластического и инерционного сопротивлений системы дыхания (Xrs). Сопротивление Rrs при частоте 5 Гц (или общее сопротивление Rrs5) отражает сопротивление внегрудных, центральных и МДП, тогда как сопротивление Rrs при частоте 20 Гц (или центральное сопротивление Rrs20) – внегрудных и центральных внутригрудных ДП 1-й генерации. Как известно, в норме сопротивление МДП невелико, поэтому и разница между Rrs5 и Rrs20 незначительна, т.е. не существует частотной зависимости сопротивления. При ДМДП сопротивление Rrs при низких частотах существенно возрастает и снижается с нарастанием частоты осцилляций, возникает частотная зависимость Rrs (Rrs5-Rrs20 >0,07 кПа·сек/л), что дает возможность оценить сопротивление МДП9. Частота встречаемости ДМДП у пациентов с ХОБЛ возрастает по мере прогрессирования заболевания. Было показано, что при вентиляционных нарушениях легкой степени (GOLD 1) ДМДП была выявлена у 57% пациентов, при GOLD 2 – у 87% и при тяжелых обструктивных нарушениях вентиляции (GOLD 3–4) – в 100% случаев10. Для диагностики ДМДП также используют такие показатели ИОС, как Xrs при частоте 5 ГЦ (Хrs5), площадь под кривой Xrs (AX) и резонансную частоту (fres)11.
В последние годы возобновился интерес к методу вымывания азота при множественном дыхании (ВАМД). Технический прогресс сделал эту методику более доступной и менее трудоемкой, что позволило внедрить ВАМД в повседневную клиническую практику для оценки неравномерности вентиляции легких и диагностики ДМДП. Тест хорошо стандартизован12. Большим преимуществом данного метода является простота проведения исследования. Пациент присоединяется к системе в конце спокойного выдоха и дышит 100%-м кислородом. Выдыхаемый газ собирается до тех пор, пока весь азот не будет вымыт из легких (в клинической практике во время исследования концентрация азота не опускается ниже 1%). Во время тестирования необходимо спокойно расслабленно дышать с произвольным (в основном в педиатрической практике) или с фиксированным дыхательным объемом, равным в среднем 1 л (в диапазоне 950-1400 мл у взрослых), в течение определенного времени, не прилагая усилий и не совершая форсированных маневров. Интегральным индексом неравномерности распределения вентиляции является индекс легочного клиренса (LCI – lung clearance index). LCI показывает, во сколько раз суммарный объем, пропускаемый через легкие во время исследования для очищения их от азота (концентрация азота в конце выдоха должна снизиться до 1/40 от начальной концентрации), превосходит функциональную остаточную емкость легких (ФОЕ). Оценить ДМДП можно с помощью таких параметров ВАМД как: Sacin и Scond (индексы неравномерности распределения вентиляции ацинарной и проводящей зон, соответственно) и отношения моментов (MR1 и MR2). Параметры ВАМД могут быть использованы для оценки тяжести ХОБЛ13.
Для оценки наличия воздушной ловушки и степени ее выраженности у больных ХОБЛ в клинической практике используют бодиплетизмографию – метод, которой позволяет измерить ФОЕ и определить общую емкость легких (ОЕЛ) и остаточный объем легких (ООЛ). При условии выявления обструкции ДП с помощью спирометрии, увеличение ООЛ и его доли в структуре ОЕЛ (ООЛ/ОЕЛ) позволяет судить о наличии и степени выраженности воздушной ловушки. Кроме того, было показано, что гиперинфляция легких (увеличение ФОЕ) является независимым фактором, позволяющим предсказать снижение толерантности к физической нагрузке14 и выживаемость пациентов с ХОБЛ15. В ряде научных публикаций было продемонстрировано, что динамика клинических симптомов (одышка, физическая работоспособность) после применения как b2-агонистов16,17, так и антихолинергических препаратов18 у больных с ХОБЛ статистически значимо коррелировала с динамикой гиперинфляции легких, а не со степенью тяжести обструктивных нарушений. Однако, в повседневной клинической практике изменение статических объемов при проведении бронходилатационного теста не получило широкого распространения, что обусловлено более высокой вариабельностью этих параметров по сравнению с ОФВ1 и отсутствием четких критериев положительной реакции. При интерпретации показателей бодиплетизмографии не менее важным является оценка бронхиального сопротивления (Raw). При выраженной обструкции увеличивается не только угол наклона петли специфического Raw (рис2,а,б), но и появляется характерное булавовидное расширение на выдохе (рис. 2б), свидетельствующее о наличии воздушной ловушки.

Важное место в диагностическом алгоритме у больных с ХОБЛ занимает диффузионный тест. Измерение диффузионной способности легких (DL - в российской и в американской терминологии, тогда как в европейских странах этот показатель чаще определяют как трансфер-фактор - ТL), является клинически информативным методом определения легочного газообмена - способности легких переносить кислород из альвеолярного газа в кровь. В клинической практике наибольшее распространение для измерения DL получил метод одиночного вдоха газовой смеси, содержащей монооксид углерода (СО), с задержкой дыхания. Снижение показателя DL помогает идентифицировать больных с эмфиземой20. Кроме того, нарушение DL является статистически значимым фактором риска летальности пациентов с ХОБЛ21,22. Измерение DL также показано больным ХОБЛ с одышкой, несоразмерной тяжести обструкции.
Кроме того, было показано, что при исследовании DL информативными также является такой параметр, как альвеолярный объем (VA), который характеризует площадь газообмена и определяется по разведению инертного газа. При одновременном выполнении бодиплетизмографии и диффузионного теста с помощью параметра VA/ОЕЛ можно судить о равномерности вентиляции. Было показано, что у пациентов с ХОБЛ с выраженной неравномерностью вентиляции (VA/ОЕЛ<0,8) после реабилитационных программ отмечается менее значимое улучшение физической работоспособности по сравнению с пациентами, у которых VA/ОЕЛ>0,823.
Таким образом, современные методы функциональной диагностики позволяют проводить комплексную диагностику функции системы дыхания и дифференциальную диагностику ХОБЛ, а также мониторировать течение заболевания и своевременно прогнозировать его обострение.
Foster/ website 25/07/2023 RUS_39