Эффективность комбинаций ингаляционных кортикостероидов и β-агонистов длительного действия в условиях реальной медицинской практики: результаты многоцентрового кросс-секционного исследования у российских ПАЦИЕНТОВ С БРОНХИАЛЬНОЙ АСТМОЙ
1. Федеральное государственное бюджетное образовательное учреждение дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации: 123995, Москва, ул. Баррикадная, 2, стр. 1.
2. Федеральное государственное бюджетное образовательное учреждение высшего образования «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Министерства здравоохранения Российской Федерации: 117997, Москва, ул. Островитянова, 1.
3. Федеральное государственное автономное образовательное учреждение высшего образования «Первый Московский государственный медицинский университет имени И.М.Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет): 119991, Россия, Москва, ул. Трубецкая, 8, стр. 2.
4. Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства: 115682, Москва, Ореховый бульвар, 28.
Сведения об авторах:
Архипов Владимир Владимирович —д. м. н., профессор кафедры пульмонологии Федерального государственного бюджетного образовательного учреждения высшего образования «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Министерства здравоохранения Российской Федерации; тел.: +7 (495) 965-34-66; e-mail: aisanov@mail.ru (https://orcid.org/0000-0002-4044-674X)
Айсанов Заурбек Рамазанович — д. м. н., профессор кафедры пульмонологии Федерального государственного бюджетного образовательного учреждения высшего образования «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Министерства здравоохранения Российской Федерации; тел.: +7 (495) 965-34-66; e-mail: aisanov@mail.ru (https://orcid.org/0000-0002-4044-674X)
Авдеев Сергей Николаевич — д. м. н., член-корр. Российской академии наук, профессор, заведующий кафедрой пульмонологии Федерального государственного автономного образовательного учреждения высшего образования «Первый Московский государственный медицинский университет имени И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет), руководитель клинического отдела Федерального государственного бюджетного учреждения «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства; тел.: +7 495 708-35-76; e mail: serg_avdeev@list.ru (https://orcid.org/0000–0002–5999–2150)

Резюме



Актуальность проблемы
Подходы к терапии бронхиальной астмы совершенствуются с каждым годом, однако проблема ее контроля по-прежнему остается актуальной. Ключевую роль в терапии бронхиальной астмы играют комбинации ингаляционных глюкокортикостероидов и β2-агонистов длительного действия, однако в реальной практике такая терапия зачастую оказывается недостаточно эффективной, и уровень контроля бронхиальной астмы в популяции остается низким. Оптимизация использования этих препаратов, изменение привычных режимов терапии и внедрение в практику усовершенствованных ингаляторов могут улучшить приверженность терапии и технику ингаляции, что в свою очередь влияет на эффективность терапии.

Цель исследования
Описание ключевых характеристик выборки пациентов, получающих терапию бронхиальной астмы, в условиях реальной практики, и оценка факторов, влияющих на достижение ими контроля над астмой, в том числе на приверженность терапии.

Материалы и методы
В одномоментное кросс-секционное наблюдательное исследование в 124 центрах оказания первичной медицинской помощи 22 городов Российской федерации были включены 3214 пациента старше 18 лет, с клиническим диагнозом астмы, установленным не менее 1 года назад, которые были способны выполнить спирометрический тест и заполнить опросники ACQ-5 и TAI-12.

Результаты
Оценка контроля над астмой по опроснику ACQ-5 показала, что среди участников исследования преобладали больные с неконтролируемой астмой - 56%. Контролируемая и частично контролируемая астма диагностирована у 21% и 19%, соотвественно. Еще у 4% больных отмечалась тяжелая неконтролируемая астма. Более чем у половины больных (53.6%) опросник TAI выявил низкий уровень приверженности к терапии. Доля пациентов с контролируемой астмой и средняя частота обострений в год были достоверно ниже в подгруппах пациентов, получавших терапию экстрамелкодисперсной комбинацией ИГКС/ДДБА и комбинацией ИГКС/формотерол в режиме единого ингалятора, по сравнению с базисной терапией фиксированными и свободными комбинациями ИГКС и ДДБА.

Выводы
Основными препятствиями для достижения контроля над астмой являются низкая приверженность к терапии, монотерапия ингаляционными ГКС, ошибки при выполнении ингаляций, астма с поражением малых дыхательных путей и нежелательные эффекты терапии иГКС. Назначение комбинации иГКС-ДДБА в виде экстрамелкодисперсного аэрозоля и в режиме MART позволяет значимо увеличить контроль над астмой, снизить риск нежелательных явлений и повысить приверженность пациентов к лечению. Возможной альтернативой для улучшения контроля над астмой является назначение комбинаций иГКС-ДДБА для приема один раз в день.

Введение

Терапевтическая стратегия лечения астмы, направленная на достижение и поддержание контроля, позволяет в условиях рандомизированных клинических исследований (РКИ) добиться хорошего ответа у большинства (до 70%) больных [1, 2]. Эта стратегия поддерживается международными рекомендациями (GINA) [3] и лежит в основе Российских рекомендаций по терапии астмы [4].
Однако, в реальной клинической практике многие пациенты так и не достигают хорошего контроля над заболеванием [5–8], получая подобранные врачами дозы ингаляционных кортикостероидов (иГКС) и комбинированных препаратов. Причем повторные исследования в ряде европейских стран показали, что доля больных с плохим контролем над астмой не снизилась за последние годы [9]. В России плохой контроль является проблемой примерно для половины пациентов с астмой [10].
Существует несколько объяснений для различий, которые возникают при оценке эффективности комбинированной терапии в РКИ и реальной практике. Во-первых, процедура отбора пациентов для участия в РКИ создает недостаточно репрезентативную выборку, относительно реальной популяции пациентов [11, 12]. Во-вторых, сам факт участия в исследовании может повлиять на поведение участников [13], в частности, привести к увеличению комплаентности [14], что само по себе повышает эффективность изучаемой терапии [15].
Таким образом, реальная практика характеризуется условиями и особенностями, которые трудно или невозможно воспроизвести в РКИ. Поэтому, исследования в условиях реальной практики могут предоставить ценную дополнительную информацию относительно популяции больных астмой и лечебных подходов, применяемых в рутинной терапии пациентов [16].

Цели и задачи
Представленное исследование, опираясь на большую выборку (более 3000 пациентов), ставило своей целью представить комплексную оценку состояния больных астмой, получающих лечение у врачей первичного звена. Задачами исследования было: 1) описание ключевых характеристик пациентов, получающих лечение в условия реальной клинической практики и 2) оценка факторов, влияющих на достижение контроля над астмой, включая комплайнс. Кроме того, в исследовании проводилась оценка распространенности относительно новых подходов к назначению комбинаций ингаляционных глюкокортикостероидов (иГКС) с β2-агонистами длительного действия (ДДБА): применение экстрамелкодисперсных аэрозолей, использование фиксированных комбинаций иГКС-формотерола для базисной терапии и купирования симптомов (MART) и назначение комбинации флутиказона фуроат - вилантерол один раз в сутки. В рамках исследования впервые проведена ретроспективная оценка влияния этих режимов терапии на уровень контроля над астмой в условиях реальной практики. Еще одной особенностью исследования была оценка приверженности к лечению, выполненная при помощи опросника «Test of the Adherence to Inhalers» (TAI) [17].

Пациенты и методы
- Дизайн исследования и исследуемая популяция
Мы провели одномоментное кросс-секционное наблюдательное исследование в 124 центрах оказания первичной медицинской помощи из 22 городов Российской федерации. Исследование проводилось с апреля по декабрь 2018 г.
Больные включались в исследование по мере посещения центров оказания первичной медицинской помощи. В исследование были включены больные >18 лет, с клиническим диагнозом астмы, установленным не менее 1 года назад, которые были способны выполнить спирометрический тест и заполнить опросники ACQ-5 и TAI-12. В исследование не включались больные в состоянии обострения, а также пациенты у которых в первичной медицинской документации не было сведений о терапии, проводимой в течение последних 6 месяцев.
Исследование получило одобрение локальных этических комитетов лечебных учреждений и было проведено в соответствии с административными и регуляторными регламентами для рутинной медицинской практики, принятыми в РФ. Исследование не включало дополнительных диагностических или терапевтических вмешательств, не предусмотренных Федеральными рекомендациями по ведению больных астмой [4]. У всех пациентов было получено информированное согласие на участие в исследовании.
Статус контроля над астмой на визитах устанавливался двумя путями:
1. заполнение опросника Asthma Control Questionnaire (ACQ-5). [18]) и
2. оценка врача-исследователя по критериям GINA [3].
Уровень приверженности терапии оценивался у каждого больного путем заполнения опросника «Test of the Adherence to Inhalers» (TAI) [17], в котором 50 баллов соотвествует хорошей, 46-49 баллов — промежуточной, а ≤45 баллов — плохой приверженности к применению назначенных ингаляционных препаратов.
Всем больным проводилась спирометрия в соответствии со стандартами Американского и Европейского респираторных обществ (American Thoracic Society/European Respiratory Society) [19] и клинический анализ крови.
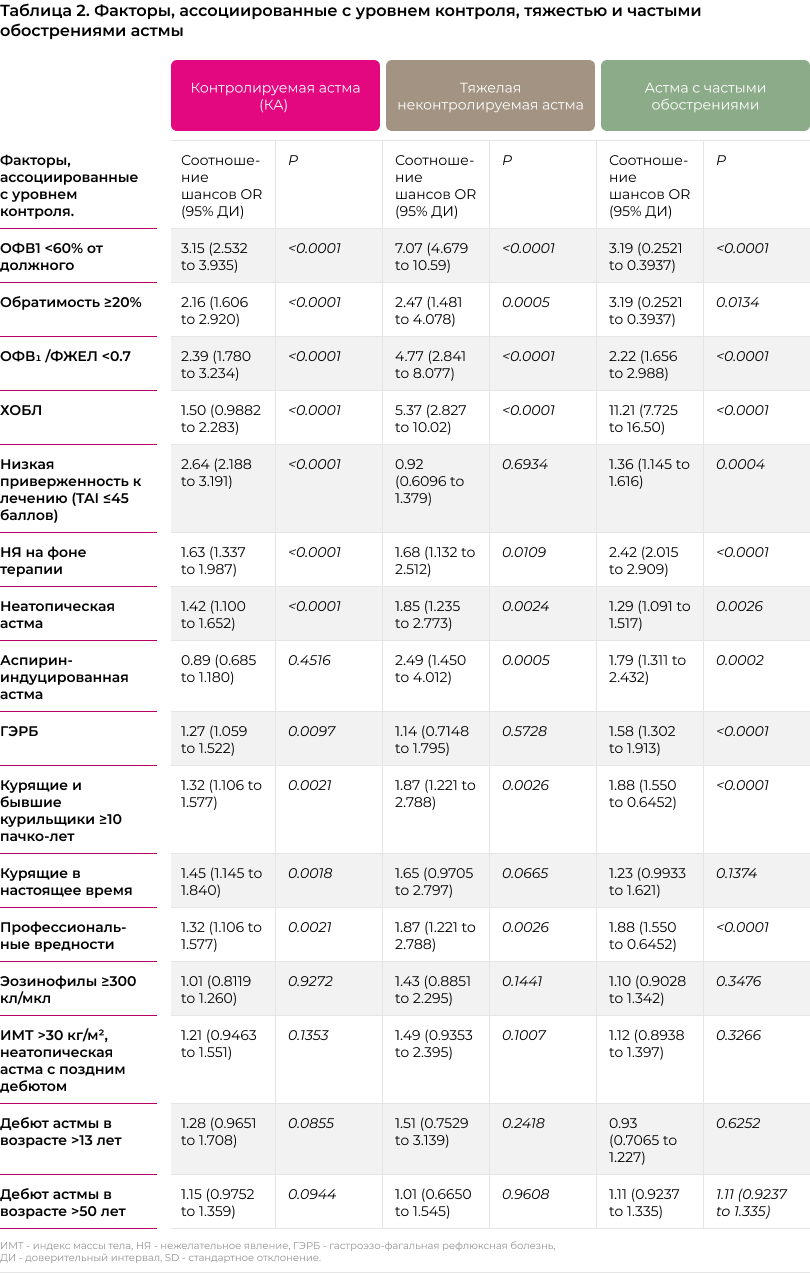
Для проведения анализа больные были стратифицированы по уровню контроля над астмой в соответствии с результатами заполнения опросника АCQ-5. Дополнительно нами выделялась группа больных с тяжелой астмой. К этой группе относились больные, получающие терапию, соответствующую шагу 5 по GINA 2019, и имеющие ≥1.5 баллов по шкале ACQ [20]. Мы оценили распространенность больных с различными уровнями контроля среди пациентов, включенных в исследование, и провели сравнение демографических и клинических показателей в разных стратах. Отдельно для больных с неконтролируемой и тяжелой неконтролируемой астмой был проведен анализ факторов, сопряженных с плохим ответом на терапию, таких как фиксированная обструкция (ОФВ1 /ФЖЕЛ <0.7, определялась как сохранение ОФВ1 /ФЖЕЛ <0.7 после ингаляции бронходилататора [21]), ожирение (индекс массы тела ≥30 кг/м2), дебют астмы в позднем возрасте, аспирин-индуцированная астма, гастроэзофагальная рефлюксная болезнь (ГЭРБ), курение, профессиональные вредности и низкая приверженность к лечению (TAI ≤45 баллов).
Также нами была проведена оценка уровня контроля над астмой (по ACQ-5) и частоты обострений в зависимости от стратегии применения комбинированной терапии на 3-4 шагах по GINA. Для этого пациенты, получающие иГКС-ДДБА, были разделены на пять групп:
1. ИГКС-ДДБА в виде свободных комбинаций (в разных ингаляторах),
2. ИГКС-ДДБА в виде фиксированных (в одном ингаляторе) комбинаций ,
3. Комбинация ИГКС-ДДБА в виде экстрамелкодисперсного аэрозоля,
4. ИГКС-формотерол для базисной терапии и купирования симптомов (MART) и
5. ИГКС-ДДБА для приема один раз в день.
Эти группы сравнивались по среднему значению ACQ, среднему числу обострений, требующих медицинской помощи за последний год (при условии, что терапия не изменялась за это время), степени приверженности лечению (по опроснику TAI) и доле больных, у которых на фоне лечения отмечались нежелательные лекарственные реакции (осиплость голоса, орофарингиальный кандидоз, частые респираторные инфекции и т.д.), которые по мнению исследователей были связаны с приемом иГКС-ДДБА.
В рамках исследования проводилась оценка фенотипов бронхиальной астмы у всех пациентов, однако, с учетом того, что для выбора дальнейшей терапии в настоящее время рекомендовано учитывать фенотип только тяжелой астмы, в эту публикацию вошла только оценка фенотипов у пациентов с тяжелой астмой. При оценке фенотипы выделялись по следующим критериям: 1) время дебюта астмы (в возрасте до 13 лет - ранняя астма, с 13-ти лет - поздняя астма [22]); 2) число эозинофилов (эозинофильный фенотип определялся у больных с ≥300 клеток/мкл [23]); 3) индекс массы тела (астма ассоциированная с ожирением при величине ИМТ≥30 кг/м2 [24]); 4) атопия (положительные аллергические тесты в анамнезе); 5) аспирин-индуцированная астма.
Наконец, в ходе визита, врачи первичного звена должны были оценить технику выполнения ингаляционного маневра. Оценка техники выполнения ингаляций относиться к компетенции лечащего врача, поэтому мы не устанавливали список критических ошибок. Врач отмечал «критическую ошибку», если она была, по его мнению, достаточно серьезной и требовала дополнительного обучения или даже замены ингалятора.
 1. Больные, набравшие ≤0.75 баллов по опроснику Asthma Control Questionnaire (ACQ-5), рас-ценивались как пациенты с контролируемой астмой, значения ACQ-5 в диапазоне 0.75-1,5 соответствуют частичному контролю над заболеванием, а ≥1.5 баллов – неконтролируемой астме.
1. Больные, набравшие ≤0.75 баллов по опроснику Asthma Control Questionnaire (ACQ-5), рас-ценивались как пациенты с контролируемой астмой, значения ACQ-5 в диапазоне 0.75-1,5 соответствуют частичному контролю над заболеванием, а ≥1.5 баллов – неконтролируемой астме.
2. Кроме формотерола/ДДБА, назначенного в виде экстрамелкодисперсной аэрозоли и/или в виде для базисной терапии и купирования симптомов 
Для описания качественных переменных применялись абсолютные значения и проценты. При описании количественных переменных использовались измерения центральной тенденции (среднее значение, медиана), измерения положения (квартили) и дисперсии (SD). Характеристики пациентов сравнивали с использованием ANOVA для множественных сравнений. Тест χ2 (критерий Фишера для частот) применялся для сравнения категорий. Анализ был выполнен для полного набора данных анализа и наборов данных подгрупп. Статистическая значимость была установлена на уровне α = 0,05. Расчеты проводились при помощи статистического пакета GraphPad Prism version 8.0.0 for Mac OS (GraphPad Software, San Diego, California USA, www.graphpad.com).

Результаты
За время проведения исследования в исследовательские центры обратился 3921 пациент с бронхиальной астмой, из числа которых 3214 пациентов были включены в исследование. Среди участников исследования 64.3% были женщинами, а средний возраст участников составил 52.6 (15.9 SD) лет. Средняя продолжительность заболевания на момент проведения исследования - 13.2 (10.7) лет. Характеристики участников исследования в зависимости от уровня контроля над астмой представлены в таблице 1.
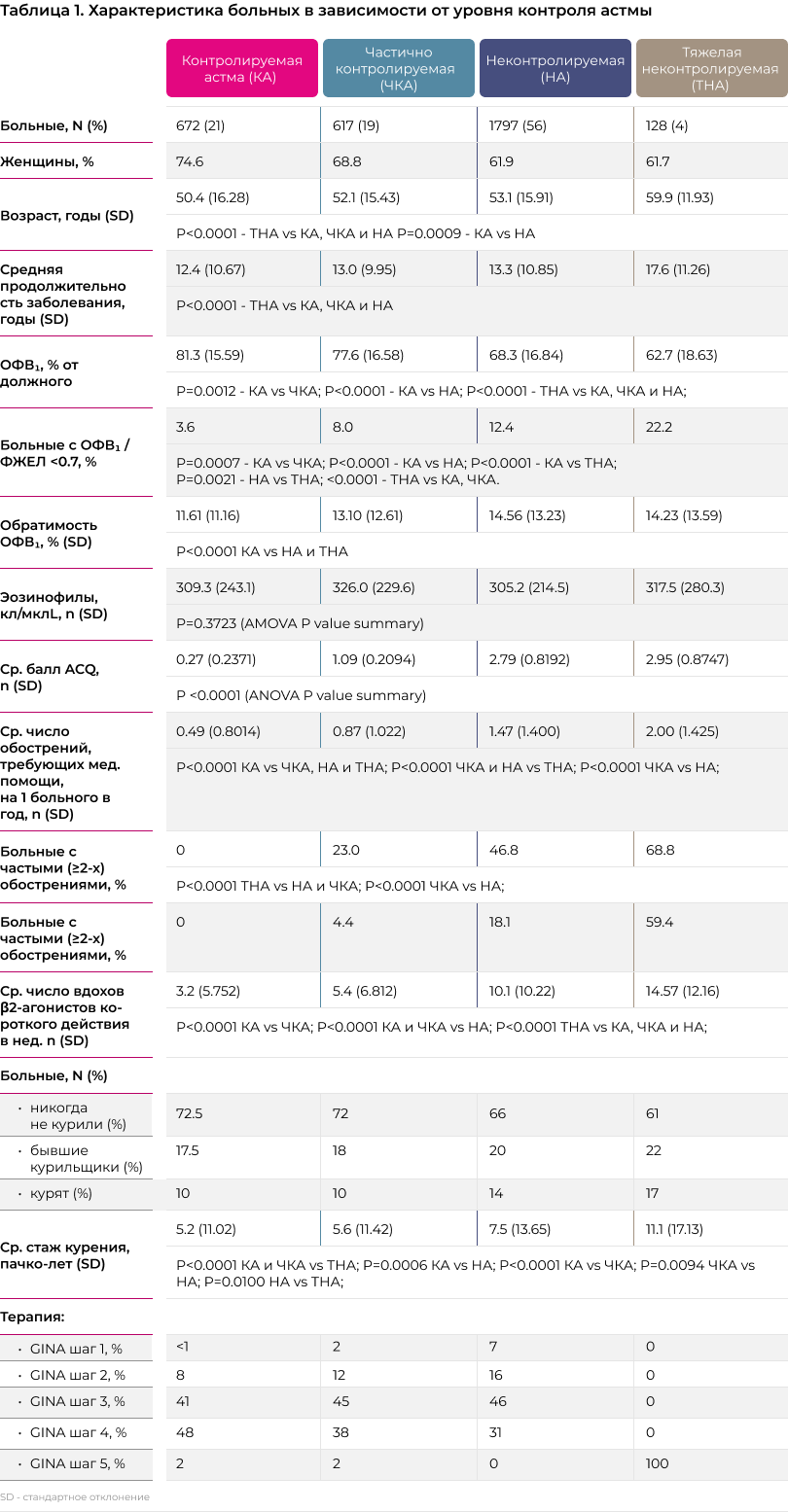
За время проведения исследования в исследовательские центры обратился 3921 пациент с бронхиальной астмой, из числа которых 3214 пациентов были включены в исследование. Среди участников исследования 64.3% были женщинами, а средний возраст участников составил 52.6 (15.9 SD) лет. Средняя продолжительность заболевания на момент проведения исследования - 13.2 (10.7) лет. Характеристики участников исследования в зависимости от уровня контроля над астмой представлены в таблице 1.

Согласно оценке по опроснику ACQ, среди участников исследования преобладали больные с неконтролируемой астмой - 56%. Контролируемая и частично контролируемая астма диагностирована у 21% и 19%, соотвественно. Пациенты с тяжелой некотролируемой астмой выделялись отдельно, их доля составила 4% от общей популяции пациентов, включенных в исследование. Параллельно с оценкой по ACQ исследователи должны были предоставить оценку уровня контроля, опираясь на методики, принятые в их рутинной практике. Согласно оценке врачей первичного звена на долю контролируемой, частично контролируемой и неконтролируемой астмы приходилось 18.3%, 51.6% и 31.1%, соответственно.
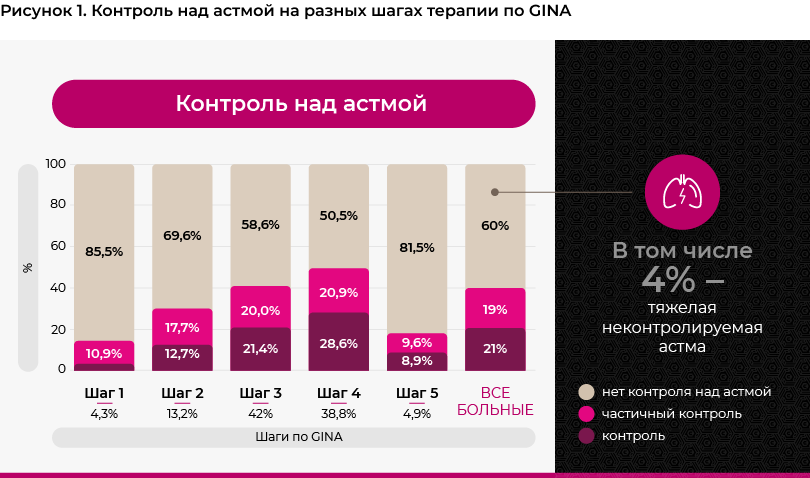
Минимальная доля больных с контролируемой астмой (3.6%) была выявлена среди больных, не получавших иГКС (GINA шаг 1). Затем по мере увеличения объема терапии доля больных с контролем над астмой увеличивается до 28.6% на 4 шаге по GINA 2019. Однако, на 5-м шаге терапии доля больных с контролируемой астмой снижается до 8.9% (см. рисунок 1).
Больные в группе тяжелой неконтролируемой астмой оказались достоверно старше, чем в остальных группах (P<0.0001), а продолжительность заболевания на 4-5 лет больше, чем в других группах. В порядке снижения контроля над астмой (от контролируемой до тяжелой неконтролируемой) у больных отмечалось достоверное сокращение величины объема форсированного выдоха за первую секунду (ОФВ1). По сравнению с больными, у которых астма контролировалась, величина ОФВ1 в группе с частичным контролем оказалась на 4.5% ниже (P=0.0012), в группе неконтролируемой астмы на 16% ниже (P<0.0001), а в группе с тяжелой неконтролируемой астмой на 23% ниже (P<0.0001). Также по мере снижения контроля достоверно увеличивалась доля больных с фиксированной обструкцией: от 3.6% среди больных с контролируемой астмой до 22% у больных с тяжелой астмой (P<0.0001). исследователи затрудняются ответить на вопрос, почему доля фиксированной обструкции среди пациентов с тяжелой астмой была ниже, чем аналогичные показания в литературных источниках. Данные о точной распространенности фиксированной обструкции воздушного потока среди пациентов с астмой ограничены, но, как правило, исследования дают оценки от 20% [25] до 49% [26]. В любом случае различия в оценках между исследованиями выполненными в разные годы, в разных странах, у больных, получавших разную терапию довольно обычное дело, не требующее комментариев, тем более, что речь не идет о первичных точках исследования. Число обострений в группе с тяжелой неконтролируемой астмой оказалось в 4 раза выше по сравнению группой хорошего контроля (P<0.0001). С другой стороны, исследование не выявило достоверных различий между группами с разным уровням контроля над астмой по числу эозинофилов крови (см. таблицу 1).
Фенотипы определялись у всех больных, но поскольку только при тяжелой астме фенотип имеет клиническое значение и может определять выбор терапии, то именно результаты по тяжелой астме вошли в настоящую публикацию.

Распределение пациентов по фенотипам представлено на рисунке 2.
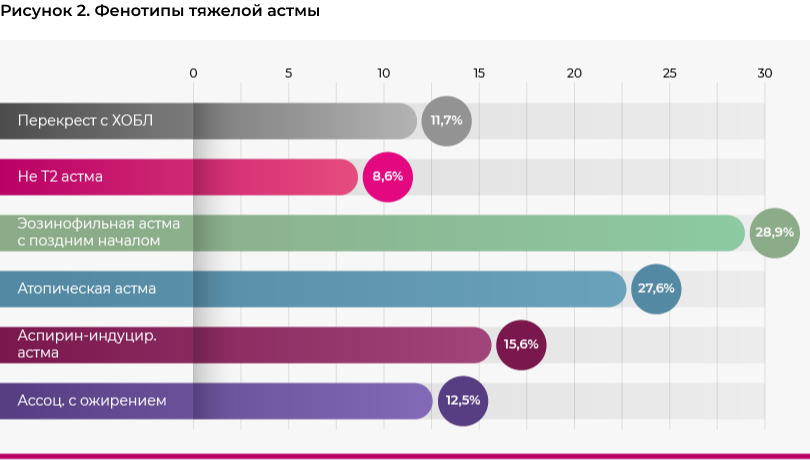
Возрастной лимит для понятия астма с поздним дебютом никогда не был строго установлен. Описывая астму с поздним дебютом, исследователи выбирали в качестве нижней планки возраст пациентов от 12 лет [27] до 65 лет [28]. Потому в нашей статье мы используем для описания случаев с поздним возникновением астмы два совершенно формально выбранных возраста: >13 лет и >50 лет.
Сравнение средней величины ACQ не выявило клинически значимых различий между исследуемыми фенотипами тяжелой астмы. Но при этом среди больных с аспирин-индуцированной астмой и астмой в сочетании с ХОБЛ среднее число обострений и госпитализаций оказалось достоверно выше (p<0.01), чем у больных с любыми другими фенотипами. Также у больных с сочетанием астма и ХОБЛ отмечались наиболее низкие показатели спирометрии, но при этом уровень обратимости обструкции после назначения сальбутамола был достоверно выше, чем при любом другом клиническом фенотипе.
Следует отметить, что настоящее исследование не смогло предоставить должную оценку фенотипам тяжелой астмы из-за того, что подобные больные относительно редко встречаются в практике врачей первичного звена.
Исследование не предполагало исследований, опираясь на которые можно было бы констатировать заинтересованность малых дыхательных путей у больных астмой. Тем не менее, опираясь на клинические признаки, перечисленные в Российских согласованных рекомендациях [29], можно заключить, что значимая часть пациентов имеют клинические особенности, свойственные для астмы с вовлечением малых дыхательных путей: больные с фиксированной обструкцией (27.7%), пациенты с сочетанием астмы и ХОБЛ (16%), курящие больные (13%) и бывшие курильщики (18.9%).
По мнению исследователей, из числа больных, включенных в исследование, 7.3% пациентов совершали ингаляции с критическими ошибками. Ср. число обострений в этой группе больных оказалось на 55% выше, чем у пациентов, адекватно выполнявших ингаляционный маневр (RR 1.55; P<0.0001). Такие больные также имели клинически и статистически достоверно более низкий уровень контроля над астмой по шкале ACQ (Δ 0.83 балла; P<0.0001). Кроме того, у 15% больных имелись заболевания и состояния, которые потенциально могли отрицательно повлиять на выполнение ингаляционного маневра (тремор, нарушение мелкой моторики, артриты суставов кисти, сниженное зрение, проблемы с запоминанием и т.п.). Больные с такими состояниями также достоверно хуже контролировали заболевание (см. рисунок 3).


Более чем у половины больных (53.6%) опросник TAI выявил низкий уровень приверженности к терапии. Хорошая и промежуточная приверженность отмечалась у 19.6% и 26.8% больных, соотвественно. В 75.5% случаев больные спорадически забывали принимать препараты, но наряду с этим 68.7% респондентов сообщили о том, что они периодически, по разным причинам, прекращали выполнять ингаляции. Наконец, в 10.2% случаев некомплаентность была связана с том, что больные не знали режима дозирования или не умели правильно обращаться с ингалятором.
Самая высокая доля больных с низкой приверженностью к лечению отмечалась на 1-м шаге терапии по GINA - 71.0%, по мере увеличения объема терапии число некомплаентных пациентов снижалось так, что на пятом шаге только 31.7% больных имели низкие показатели приверженности по TAI (см. рисунок 4).


Сравнение среднего значения ACQ показало, что больные с хорошей приверженностью к терапии имели статистически (P<0.0001) и клинически (-0.51 балл) достоверно более высокий уровень контроля над заболеванием (см. рис. 5) по сравнению с пациентами с плохой приверженностью. У больных, которые получали иГКС-ДДБА в режиме MART, среднее значение TAI оказалось достоверно выше, по сравнению с больными, которые получали иГКС-ДДБА дважды (различия 1.55 балла, Р=0.0029) или один раз в день (различия 3.07 балла, P=0.0009) - см. таблицу 3.
Рисунок 5. Приверженность к терапии (оценка по шкале TAI-12) и средний уровень контроля над астмой (по опроснику ACQ-5).

- Ответ на комбинированную терапию
Ответ на комбинированную терапию изучался у больных на 3 и 4 шагах GINA 2019 (см. таблицы 4 и 5). Больные с тяжелой астмой, получающие терапию в рамках шага 5, в этот анализ не включались. Обобщенные результаты для шага 3 и 4 представлены на рисунке 5. Как видно из представленных результатов, больные, получавшие более современные лекарственные препараты и режимы терапии, а именно, иГКС/ДДБА в режиме MART и иГКС-ДДБА в форме экстрамелкодисперсного аэрозоля (БДП/формотерол), имели достоверно более высокий уровень контроля над астмой, по сравнению с приемом обычных иГКС-ДДБА дважды в день. Также у пациентов, находящихся на 4 ступени терапии по GINA, лучший контроль достигался при использовании комбинации флутиказона фуроат/вилантерол (ФФ/В) для приема один раз в день, однако в связи с тем, что врачи-исследователи не включили в исследование пациентов, получавших низкую дозу ФФ/В, получить данные для 3 ступени не представилось возможным. При этом различия в уровне контроля превышали уровень минимальных клинически значимых отличий (>0.5 баллов по шкале ACQ). Кроме того, терапевтические опции, включавшие иГКС/ДДБА в форме экстрамелкодисперсного аэрозоля и иГКС/ДДБА в режиме MART, продемонстрировали достоверно более низкую частоту обострений бронхиальной астмы, по сравнению с традиционной базисной терапией иГКС/ДДБА в форме дозированных аэрозольных ингаляторов и порошковых ингаляторов с масс-медианным размером частиц в пределах 2-5 мкм (на 35% и 45% ниже, соответственно), что продемонстрировано на рисунке 6. В отношении иГКС/ДДБА для однократного применения достоверного снижения частоты обострений показано не было, что может быть связано с небольшим количеством пациентов в этой подгруппе, не позволившей достичь статистической значимости.


По сравнению с больными, которые получали фиксированные комбинации иГКС-ДДБА, пациенты, которым были назначены свободные комбинации этих препаратов, имели более низкие показатели контроля над заболеванием, чаще использовали дополнительные ингаляции для облегчения симптомов. У этих больных чаще отмечались обострения астмы.
- Нежелательные эффекты терапии
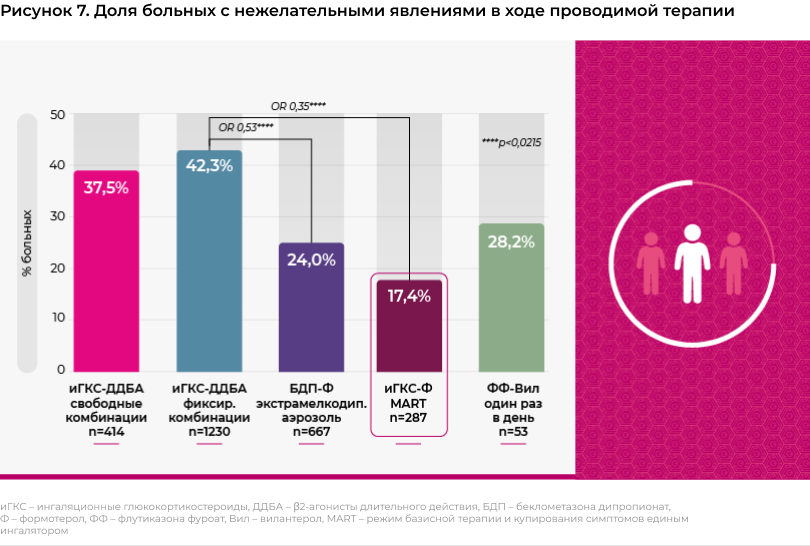
Нежелательные эффекты иГКС-содержащей терапии были зарегистрированы у 31,7% больных общей популяции исследования (среди пациентов на 5-м шаге терапии - в 38% случаев). Максимальная частота возникновения нежелательных явлений отмечалась у пациентов, получавших наиболее распространенные препараты для лечения среднетяжелой и тяжелой астмы, - фиксированные комбинации иГКС/ДДБА в форме дозированных аэрозольных ингаляторов и порошковых ингаляторов с масс-медианным размером частиц в диапазон от 2 до 5 мкм (нежелательные явления отмечались у 42,3% пациентов этой группы) и свободные комбинации иГКС и ДДБА (37,5% пациентов). Однако использование более современных лекарственных препаратов и режимов терапии позволяло улучшить переносимость терапии. Так, при использовании фиксированной комбинации иГКС/ДДБА, применяемой один раз в день, 28,2% пациентов отмечали возникновение нежелательных явлений. При использовании иГКС/ДДБА в форме экстрамелкодисперсного аэрозоля, нежелательные явления отмечались на 40-47% реже, по сравнению с пациентами, получавшими комбинированные препараты в виде обычных дозированных аэрозолей и порошковых ингаляторов, и эта разница была достоверной. Наилучшая переносимость отмечалась в подгруппе пациентов, получавших комбинацию иГКС/ДДБА в режиме MART: доля пациентов, испытывавших нежелательные явления на фоне терапии единым ингалятором, была наименьшей среди всех пациентов исследования (рисунок 7).

Обсуждение

Выборка данного исследования отражает популяцию больных астмой, постоянно обращающихся к врачам первичного звена. Больные включались в исследование по мере обращения к врачу, единственными ограничениями для участия в исследовании были обострения астмы и неспособность больного заполнить предложенные вопросники. Такими образом, в исследование было включено более 80% больных из числа пришедших на визит к врачу.
Среди больных, включенных в исследование, независимо от объема терапии преобладали пациенты с неконтролируемой астмой (см. рисунок 1). По сравнению с аналогичным исследованием российских больных, проведенным в 2010 г [10], данное исследование не выявило положительных тенденций в плане контроля над астмой.
Полученные нами данные позволяют идентифицировать ряд факторов, которые мешают больным хорошо контролировать бронхиальную астму. В первую очередь следует указать на низкую приверженность больных к терапии более чем в половине случаев. При этом оказалось, что больные не только забывают принимать препараты для базисной терапии (75,5% опрошенных), но не менее часто по разным причинам прерывают терапию без консультации врача (68,7%). Нежелательные явления от проводимой терапии, в течение года предшествовавшего включению в исследование, были зарегистрированы у 31.7% больных. Дополнительный анализ показал, что у больных с нежелательными явлениями приверженность к терапии (оценка по ср. баллу TAI) достоверно снижалась (P=0,0012).
Вторая группа факторов, ассоциированных с недостаточным контролем над астмой, включает низкие показатели спирометрии, высокую степень обратимости и формирование фиксированной обструкции. Идентификация этих факторов указывает на необходимость проведения плановых спирометрических исследований в дополнение к клинической оценке уровня контроля.
Определение клинического фенотипа заболевания у больных с нетяжелой астмой, по-видимому, не имеет большой клинической ценности для выбора медикаментозной терапии. Нам не удалось идентифицировать клинически значимых различий между отдельными фенотипами, за исключеним более тяжелого течения астмы у больных с ACO и аспирин-ассоциированной астмой. С другой стороны, настоящее исследование не cмогло предоставить должную оценку фенотипов тяжелой неконтролируемой астмы, так как подобные больные относительно редки в практике врачей первичного звена: 4% от общего числа.
Исследование показало, что в условиях реальной практики существуют потенциальные механизмы для увеличения приверженности к терапии и повышения уровня контроля. Во-первых, назначение комбинаций иГКС-формотерол в режиме MART позволяет достоверно увеличить приверженность терапии, увеличить контроль заболевания и на 45% снизить число обострений и частоту нежелательных эффектов, по сравнению с терапией иГКС/ДДБА в обычном режиме (см. рисунок 5). Во-вторых, повышению эффективности терапии способствовало использование на 3 и 4-ом шагах терапии новых методов терапии. Применение фиксированной комбинации иГКС/ДДБА в форме экстрамелкодисперсного аэрозоля обеспечивало достоверное улучшение контроля астмы и снижение частоты обострений, по сравнению с наиболее распространенными комбинациями иГКС/ДДБА и свободными комбинациями иГКС и ДДБА. Кроме того, высокая эффективность в отношении достижения контроля астмы была продемонстрирована в группе пациентов, получавших комбинацию иГКС/ДДБА (флутиказона фуроат/вилантерол) для использования один раз в день. Помимо продемонстрированной эффективности в отношении контроля астмы и риска обострений, использование новых методов ингаляционной терапии также характеризовалось благоприятным профилем переносимости и более редкими нежелательными эффектами, по сравнению с привычными комбинациями.

Дисклеймеры

«Публикация осуществлена при поддержке компании «Кьези Фармасьютикалс». Мнение автора может не совпадать с позицией компании. Компания «Кьези Фармасьютикалс» не несет ответственности за возможные нарушения авторских прав и иных прав третьих лиц в результате публикации и распространения данной информации».
Авторы публикации заявляют об отсуствии конфликта интересов.

Foster/ website 23/11/2021 RUS_13